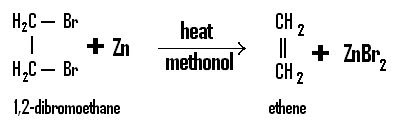
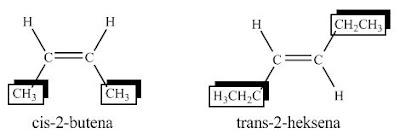
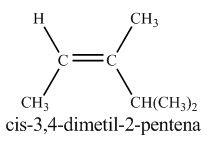
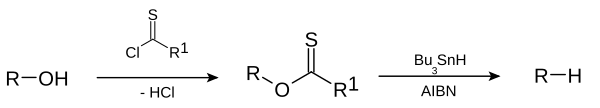
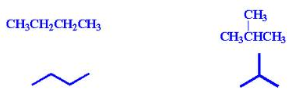Alkana pada alam semesta
Metana dan etana adalah salah satu komponen kecil dari atmosfer Yupiter.

Ekstraksi dari minyak bumi, yang mengandung banyak komponen hidrokarbon, termasuk alkana.
Alkana adalah senyawa yang terdapat pada sebagian kecil dari atmosfer beberapa planet seperti Yupiter (0.1% metana, 0.0002% etana),Saturnus (0.2% metana, 0.0005% etana), Uranus (1.99% metana, 0.00025% etana) dan Neptunus (1.5% metana, 1.5 ppm etana). Titan(1.6% metana), salah satu satelit dari Saturnus, telah diteliti oleh Huygens bahwa atmosfer Titan menurunkan hujan metana secara periodik ke permukaan bulan itu.[5] Di Titan juga diketahui terdapat sebuah gunung yang menyemburkan gas metana, dan semburan gunung ini menyebabkan banyaknya metana pada atmosfer Titan. Selain itu, ditemukan oleh radar Cassini, terlihat juga ada beberapa danau metana/etana di kawasan kutub utara dari Titan. Metana dan etana juga diketahui terdapat pada bagian ekor dari kometHyakutake. Analisis kimia menunjukkan bahwa kelimpahan etana dan metana hampir sama banyak, dan hal itu menunjukkan bahwa es metana dan etana ini terbentuk di antara ruang antar bintang. [6]
Alkana di bumi
Gas metana (sekitar 0.0001% atau 1 ppm) ada di atmosfer bumi, diproduksi olwh organisme macam Archaea dan juga ditemukan pada kotoran sapi.
Sumber alkana yang paling penting adalah pada gas alam dan minyak bumi.[4] Gas alam mengandung metana dan etana, dengan sedikit propana dan butana, sedangkan minyak bumi adalah campuran dari alkana cair dan hidrokarbon lainnya. Hidrokarbon ini terbentuk dari jasad renik dan tanaman (zooplankton dan fitoplankton) yang mati, kemudian terkubur di lautan, tertutup oleh sedimentasi, dan berubah setelah terkena panas dan tekanan tinggi selama jutaan tahun. Gas alam terbentuk dari reaksi di bawah ini:
- C6H12O6 → 3CH4 + 3CO2
Alkana yang berwujud padat dikenal sebagai tar. Tar terbentuk ketika senyawa alkana lain yang lebih ringan menguap dari deposit/sumber hidrokarbon. Salah satu deposit alkana padat alam terbesar di dunia adalah danau aspal yang dikenal dengan namaDanau Pitch di Trinidad dan Tobago.
Metana juga terdapat pada biogas yang diproduksi oleh hewan ternak. Biogas ini dapat menjadi sumber energi terbaharui di kemudian hari.
Alkana hampir tidak dapat bercampur dengan air, jadi kandungannya dalam air laut bisa dikatakan amat sedikit. Meski begitu, pada tekanan yang tinggi dan suhu rendah (seperti di dasar laut), metana dapat mengkristal dengan air untuk membentuk padatan metana hidrat. Meskipun saat ini padatan ini masih belum bisa dieksploitasi secara komersial, tapi energi pembakaran yang dihasilkan diperkirakan cukup besar. Maka dari itu, metana yang diekstraksi dari metana hidrat dapat dianggap sebagai bahan bakar masa depan.
Pada bidang biologi
Bakteria dan archaea

Archaea Metanogenik pada kotoran sapi ini menghasilkan metana yang terlepas ke atmosfer bumi.
Beberapa jenis archaea, misalnya metanogen, memproduksi metana dalam jumlah besar ketika memetabolisme karbon dioksida atau senyawa organik lainnya. Energi dilepas ketika pengoksidasian hidrogen:
- CO2 + 4H2 → CH4 + 2H2O